FDA одобрило продажи IQOS в США — почему?
30 апреля 2019 года FDA разрешило продажу IQOS в США после двухлетней всесторонней оценки предпродажной заявки (Pre-market Tobacco Application, PMTA). С этой заявкой более подробно можно ознакомиться на сайте нашей компании. На прошлой неделе FDA выступило с обоснованием данного решения.
Ведущей вебинара выступила доктор Присцилла Кэллахан-Лион, заместитель директора отдела изучения индивидуального здоровья в научном департаменте Центра изучения табачных изделий. Доктор Кэллахан-Лион имеет за плечами 20-летний опыт частной практики в качестве пульмонолога и 10 лет работы в FDA, где она занималась вопросами, связанными как с лекарственными средствами, так и с табачной продукцией. Она занимала позицию ведущего технического специалиста по рассмотрению заявок PMTA.

Доктор Мойра Гилхрист
Во вводной части вебинара доктор Кэллахан-Лион внесла ясность в отношении нескольких важных моментов, связанных с рассмотрением подобных заявок. «Ни один табачный продукт не является абсолютно безопасным. Процесс выдачи разрешений на распространение табачной продукции не основывается на стандартах безопасности и эффективности — данный вопрос находится в совершенно другой системе координат. Мы не одобряем табачные продукты — мы выдаем разрешение на их продажу. Сегодня не существует нормативно-правового определения пригодности для целей защиты общественного здоровья.
Иными словами, говоря о пригодности, мы оперируем таким критерием, как способность продукта к сокращению заболеваемости и/или смертности, что позволяет нам квалифицировать этот продукт как пригодный для целей защиты общественного здоровья в данный момент времени. Эти стандарты могут претерпевать изменения в будущем в зависимости от рыночной конъюнктуры».
Доктор Кэллахан-Лион определила контуры подхода FDA к рассмотрению заявки и подчеркнула доскональный характер оценочной процедуры, включающей в себя не только анализ проведенных нами научных исследований, но и независимые исследования IQOS. По итогам вебинара стала совершенно очевидной степень надзора, который FDA осуществлял прежде и продолжит осуществлять в ходе продаж на территории США IQOS. Такой надзор осуществляется в отношении самого продукта, его компонентов, технологии производства и обосновывающих исследований.
Специалисты FDA проанализировали данные наших исследований, проинспектировали наши производственные объекты и провели оценку всей цепочки добавленной стоимости, связанной с IQOS.
В распоряжение Управления будут представляться маркетинговые планы до начала их реализации. «Любые проблемные моменты, в случае наличия таковых, будут нами выявляться», — заявила доктор Кэллахан-Лион.
IQOS нагревает табак вместо его сжигания
Доктор Кэллахан-Лион пояснила принцип работы IQOS: с помощью устройства происходит нагрев специальных табачных стиков до определенных температур, вследствие чего происходит образование аэрозоля без сжигания табака. Она подчеркнула, что подача энергии на нагревательный элемент прекращается в случае превышения температурного порога, выше которого может начаться процесс горения.
Меня лично удивил тот факт, что не все представители научного сообщества и эксперты в области общественного здоровья знакомы с принципом работы IQOS или ее отличиями от электронных сигарет. В этой связи объяснение, предложенное доктором Кэллахан-Лион, оказалось очень полезным.
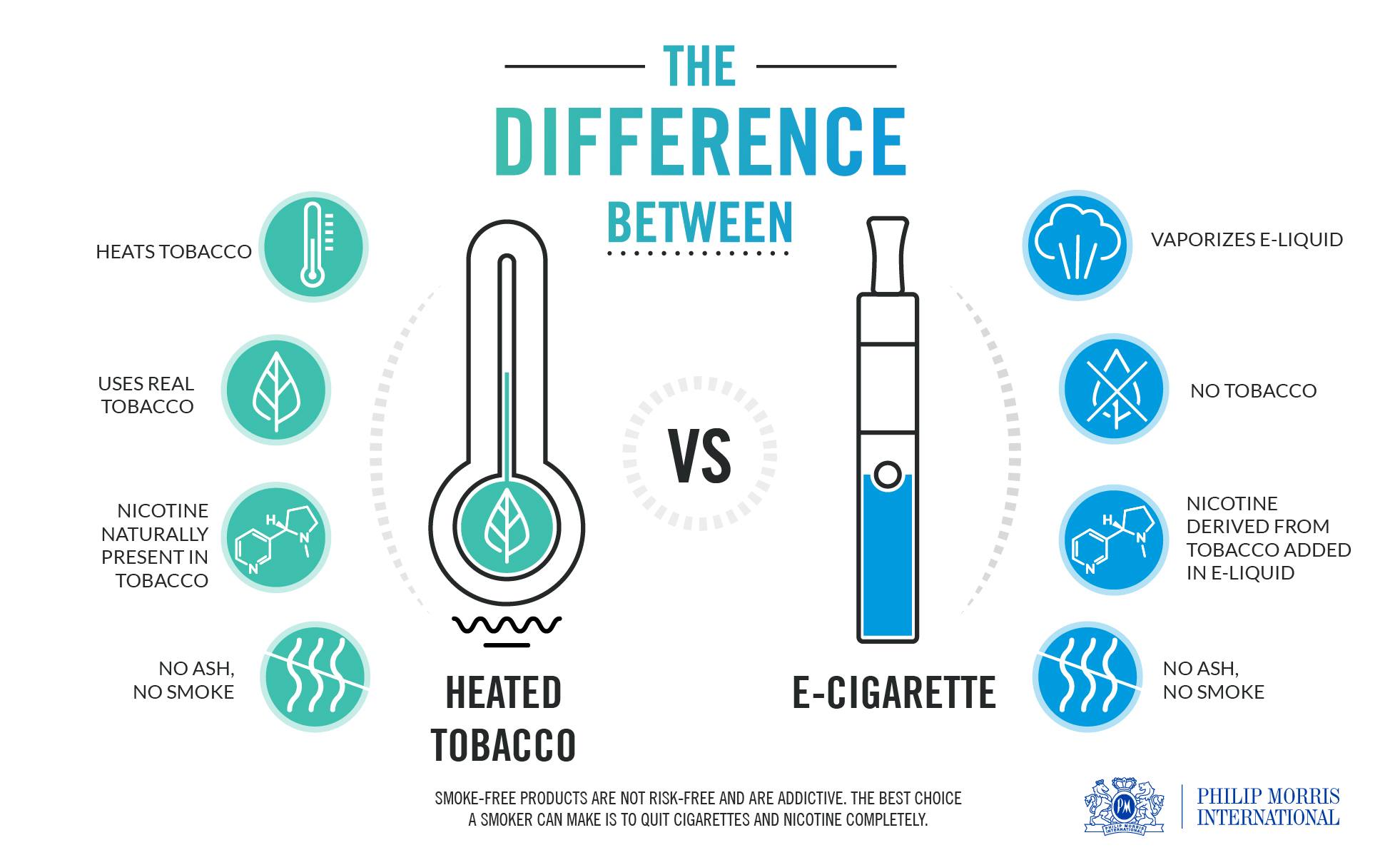
Разница между IQOS и электронной сигаретой
Более низкое содержание вредных химических веществ
Доктор Кэллахан-Лион упомянула, что представленные нами токсикологические данные указывают на потенциальные преимущества по сравнению с обычными сигаретами для взрослых курильщиков, полностью переходящих на IQOS. В частности, она отметила более низкие показатели концентрации монооксида углерода, а также акролеина и формальдегида.
Также она добавила, что наши данные указывают на возможное содержание канцерогенных или других генотоксичных веществ в аэрозолях, образующихся в процессе использования изделия, однако показатели содержания таких веществ очень невысоки: «Наш токсиколог пришел к выводу, что, несмотря на возможное содержание токсичных веществ, их концентрация крайне незначительна и их потенциальное воздействие на здоровье перевешивается значительно меньшим числом и объемом вредных и потенциально вредных компонентов по сравнению с обычными сигаретами».
Доктор Кэллахан-Лион отметила, что наши краткосрочные клинические исследования показали положительную динамику в части биомаркеров воздействия вредных и потенциально вредных компонентов, при этом данная положительная динамика сохраняется и в более долгосрочных исследованиях.
Привлекательны для совершеннолетних курильщиков, неинтересны некурящим
В FDA ожидают, что спрос на продукт со стороны молодежи, некурящих и бывших курильщиков окажется невысоким, если исходить из имеющихся данных. Доктор Кэллахан-Лион сообщила, что представители Управления выявили относительно невысокую долю людей, никогда не пробовавших сигареты (в том числе молодых людей), но проявляющих ярко выраженный интерес к изделию. Даже среди бывших курильщиков ожидаемый интерес к продукту оказался не слишком высоким. В то же время, она отметила, что уровень содержания никотина и связанное с ним удовлетворение от употребления достаточны, чтобы оказаться привлекательным для рядового курильщика. Доктор Кэллахан-Лион ясно дала понять, что в то время как IQOS вызывает привыкание, оно является не более сильным, чем в случае обычных сигарет.
В секции вебинара, посвященной показателям перехода взрослых курильщиков на IQOS, для меня стало откровением, насколько важную роль играет регулярная организация сеансов пошагового пробного использования IQOS для поощрения полного перехода на нее. Компетентные и дружественно настроенные представители, консультирующие взрослых курильщиков в процессе знакомства с изделием, облегчают для последних полный переход на IQOS в кратчайшие сроки. В конце концов, исследования в поддержку изделия не имеют никакого значения для общественного здоровья, пока курильщики не переходят на его использование.
Тревожных неблагоприятных событий, связанных с IQOS, не выявлено
По словам доктора Кэллахан-Лион, компания PMI представила уже два годовых отчета по безопасности в странах за пределами США. Она подчеркнула, что FDA, проанализировав данные из других стран, не выявило вызывающих обеспокоенность неблагоприятных событий, имеющих отношение к использованию IQOS.
Она также отметила, что у Управления нет сведений о случаях легочных заболеваний, аналогичных тем, что были недавно зарегистрированы в США.
IQOS создает новый стандарт для систем нагревания табака
Наконец, в рамках вебинара был освещен используемый в Соединенных Штатах подход к авторизации продаж альтернативных табачных продуктов: такой подход базируется на признании наличия риска, инклюзивной и прозрачной процедуре, а также принятии решений на основе тщательного анализа научно обоснованных данных. В рамках процедуры рассмотрения особое внимание уделяется качеству продукции, характеристикам аэрозолей, потенциальному воздействию на здоровье, привлекательности для некурящих (включая бывших курильщиков и молодежь), а также используемым вкусовым добавкам.
В рамках сессии вопросов и ответов в адрес FDA поступил вопрос о том, что будет использоваться в качестве основы для сравнения при вынесении решения о позитивном воздействии на общественное здоровье будущих систем нагревания табака: обычные сигареты или же IQOS. Доктор Кэллахан-Лион ответила: «При рассмотрении новых систем нагревания табака FDA будет проводить внутренние сравнения с IQOS и тем, что нам известно об этой системе. В свою очередь, мы в PMI горды тем, что наша продукция и наши сведения способствовали созданию нового эталона».

